Na sieti sa objavil ani nie tak starý príspevok (9. november 2024): „An Abiding Atrocity: Immune System Dysfunction and Cancer via SV40 Enhancer“ („Pretrvávajúce zverstvo: Dysfunkcia imunitného systému a rakovina prostredníctvom SV40 Enhancer“) https://nzdsos.com/2024/11/06/cancer-via-sv40-enhancer/
Vzhľadom na to, že nechcem nič pridávať, použijem len kópie častí textu.
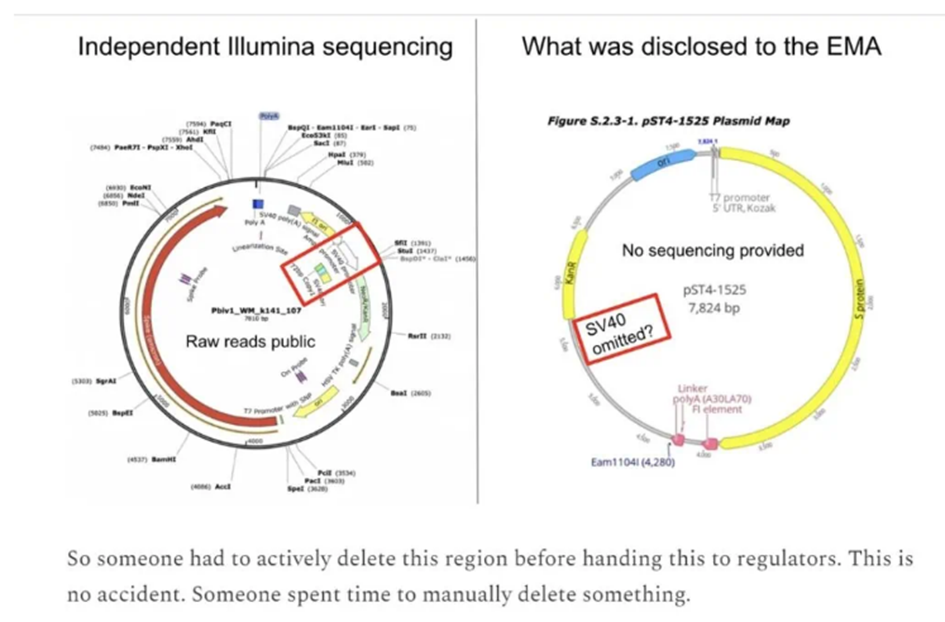
Whilst these mechanisms for causing cancer remain hypothetical, there are genuine reasons for concern, for the seemingly perverse moves being made by Pfizer towards cancer drug development, and for the increasing demand for investigations into the risks to public health being made across the world from Australia to Slovakia. Dr Rose lists the following five concerns:
- Altered Antibody Affinity and Specificity: SV40’s potential to target AID could lead to aberrant mutations in immunoglobulin genes, resulting in altered antibody affinity and specificity. This might impact the effectiveness of the immune response.
- Increased Oncogenic Activity: The SV40 virus enhancer’s ability to target AID could introduce oncogenic mutations, potentially contributing to tumorigenesis. This is supported by the observation that SV40 is associated with several human cancers [as above].
- Error-Prone Repair Mechanisms: The introduction of SV40 could activate error-prone repair mechanisms, leading to an increased frequency of insertions, deletions, and point mutations in the vicinity of DNA breaks. This might result in the creation of novel oncogenic fusion genes or the disruption of tumor suppressor genes.
- Aberrant Expression of APOBEC Enzymes: SV40’s interaction with SHM elements could lead to aberrant expression and targeting of APOBEC cytidine deaminase family enzymes, which are known to induce mutations in viral genomes. This might result in the creation of novel oncogenic mutations or the selection of pre-existing mutations.
- Disruption of Normal SHM Process: The introduction of SV40 could disrupt the normal SHM process, potentially leading to impaired antibody diversification and reduced immune responses.
Hoci tieto mechanizmy spôsobovania rakoviny zostávajú hypotetické, existujú skutočné dôvody na obavy, na zdanlivo zvrátené kroky spoločnosti Pfizer smerom k vývoju liekov proti rakovine a na rastúce požiadavky na vyšetrovanie rizík pre verejné zdravie, ktoré sa uskutočňujú na celom svete od Austrálie po Slovensko. Dr. Rose uvádza týchto päť dôvodov na obavy:
· Zmenená afinita a špecifickosť protilátok: Potenciál SV40 zamerať sa na AID by mohol viesť k aberantným mutáciám v imunoglobulínových génoch, čo by malo za následok zmenenú afinitu a špecifickosť protilátok. To by mohlo ovplyvniť účinnosť imunitnej odpovede.
· Zvýšená onkogénna aktivita: Schopnosť zosilňovača vírusu SV40 zamerať sa na AID by mohla zaviesť onkogénne mutácie, čo by mohla prispieť k nádorovému bujneniu. Potvrdzuje to pozorovanie, že vírus SV40 sa spája s viacerými ľudskými rakovinami [ako je uvedené vyššie].
· Mechanizmy opravovania chýb: Zavedenie SV40 by mohlo aktivovať mechanizmy opravy náchylné na chyby, čo by viedlo k zvýšenej frekvencii inzercií, delécií a bodových mutácií v blízkosti zlomov DNA. To by mohlo viesť k vytvoreniu nových onkogénnych fúznych génov alebo k narušeniu nádorových supresorových génov.
· Aberantná expresia enzýmov APOBEC: Interakcia SV40 s prvkami SHM by mohla viesť k aberantnej expresii a zacieleniu enzýmov rodiny cytidíndeamináz APOBEC, o ktorých je známe, že vyvolávajú mutácie vo vírusových genómoch. To môže viesť k vzniku nových onkogénnych mutácií alebo k selekcii už existujúcich mutácií.
· Narušenie normálneho procesu SHM: Zavedenie SV40 by mohlo narušiť normálny proces SHM, čo by mohlo viesť k narušeniu diverzifikácie protilátok a zníženiu imunitných reakcií.
A ešte jedna staršia práca – „Simian virus-40 as a gene therapy vector“ („SV-40 ako vektor génovej terapie“) (Vera M, Fortes P. Simian virus-40 as a gene therapy vector. DNA Cell Biol. 2004 May;23(5):271-82. doi: 10.1089/104454904323090903 )
They also efficiently transduce both resting and dividing cells, deliver persistent transgene expression to a wide range of cell types, and are nonimmunogenic. Present disadvantages of rSV40 vectors for gene therapy are a small cloning capacity and the possible risks related to random integration of the viral genome into the host genome.
Okrem toho účinne transdukujú pokojové aj deliace sa bunky, zabezpečujú trvalú expresiu transgénu v širokej škále typov buniek a nie sú imunogénne. Súčasnou nevýhodou vektorov rSV40 na génovú terapiu je malá klonovacia kapacita a možné riziká spojené s náhodnou integráciou vírusového genómu do genómu hostiteľa.
Publikované: 05.05.2025